镁及其合金因具备良好力学性能和可降解性,被视为理想的可降解植入材料。但其在体内降解过快,易引发局部碱化和氢气释放,影响组织修复效果。因此,提高其耐腐蚀性尤为关键。同时,不同临床需求也对其生物功能提出更高要求,如抗菌、抗肿瘤、促成骨等。鉴于此,本课题组通过多种表面改性手段,系统提升了医用镁合金的抗腐蚀能力及生物学性能,研究相关规律及机制。
1. 镁合金表面微弧氧化(PEO)复合涂层构建及性能调控
单一的PEO涂层表现出孔洞结构,无法为镁合金提供长期有效的保护。但是,由于PEO涂层与基体结构牢固,在PEO涂层的基础上构建复合涂层成为镁合金表面改性的研究热点之一。本课题组通过PEO技术及聚乳酸(PLLA)封孔在镁合金表面制备了PEO/PLLA复合涂层。复合涂层可以有效降低基底的腐蚀速率,同时有利于细胞在材料表面的粘附和增殖(J Biomed. Mater. Res. B Appl. Biomater., 2015, 1032, 342-354)。为了使材料表面功能化,利用聚多巴胺将肝素固定在PEO/PLLA复合涂层表面,获得了具有较好抗血小板粘附以及快速内皮化的表面 (Colloid. Surface. B, 2014, 121, 451-460)。此外我们还构建了PEO/PCL(聚己内酯)复合涂层,并通过聚多巴胺在复合涂层表面固定聚己二亚甲基联胍,提高了复合涂层的生物活性和生物相容性,同时也赋予了材料优异的抗菌性(Colloid. Surface. B, 2016, 141, 327-337)。
尽管等离子体电解氧化(PEO)涂层是镁合金表面最常用且研究最广泛的涂层之一,然而其腐蚀产物氢氧化镁(Mg(OH)2)容易被侵蚀性氯离子分解为Mg2+和OH-,从而难以起到腐蚀保护的作用。针对这一问题,我们提出一种化学保护的策略,通过调控腐蚀反应增强PEO涂层的抗腐蚀性。我们在PEO涂层表面通过简单的浸泡法,制备了一层非晶MnOOH。我们发现在腐蚀过程中,非晶MnOOH能够与腐蚀产物Mg2+和OH-自发地发生反应,形成层状双氢氧化物(LDH),从而很大程度上提高了PEO涂层的长期防腐性能(图1)。此外,PEO/MnOOH涂层对划痕具有一定的自愈能力,并可用于修复涂层聚多巴胺和氧化石墨烯薄等膜在腐蚀过程中产生的缺陷(Corrosion science, 2021, 109840)。
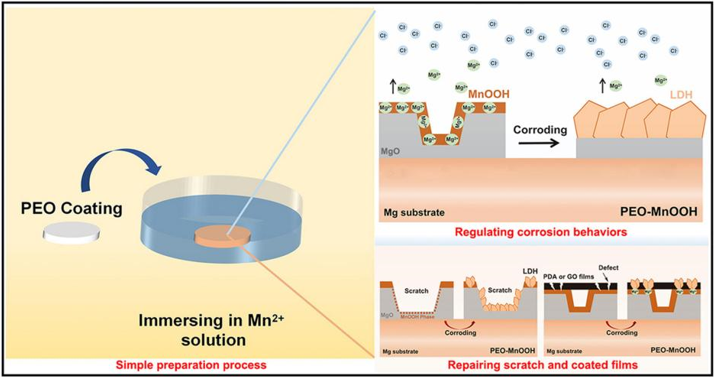
图1.PEO/MnOOH涂层的制备及调控腐蚀反应及自愈合性能
进一步通过简单浸泡处理,在等离子体电解氧化(PEO)涂层镁合金上原位生长了羟基氧化铁(FeOOH)纳米片(Chemical engineering journal,2022,437,135257)。制备的FeOOH纳米片完全密封了PEO涂层的多孔结构,从而显著提高了镁合金的耐腐蚀性和生物相容性。此外,FeOOH薄膜可以通过两种方式提供抗菌活性:1)光催化效应,可防止镁植入物在储存和运输过程中的细菌感染;2)光热抗菌效应,通过近红外光照射样品可以有效杀死粘附在小鼠皮下植入物上的金黄色葡萄球菌(图2)。此外,FeOOH纳米片增强镁合金植入物显著促进了成骨细胞粘附、铺展和增殖,并加速了体内成骨。
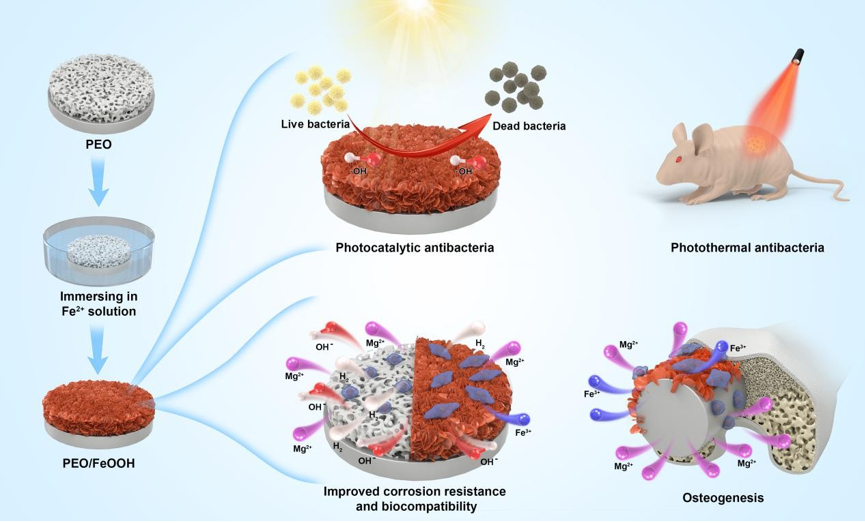
图2. FeOOH薄膜制备以及抗菌成骨效应示意图
2. 镁合金表面层状双氢氧化物(LDH)基涂层构建及性能调控
很多研究者通过水热法在镁合金表面生成致密的氢氧化镁层来提高镁合金的抗腐蚀性,但是,单纯的氢氧化镁层很容易被溶液中的阴离子特别是氯离子破坏。本工作成功地将Mg-Al LDH相引入到氢氧化镁涂层中,通过Mg-Al LDH的离子交换作用,降低材料周围的氯离子浓度,从而提高涂层的抗腐蚀性(图3)(ACS Appl. Mater. Interfaces, 20168(51),35033-35044)。
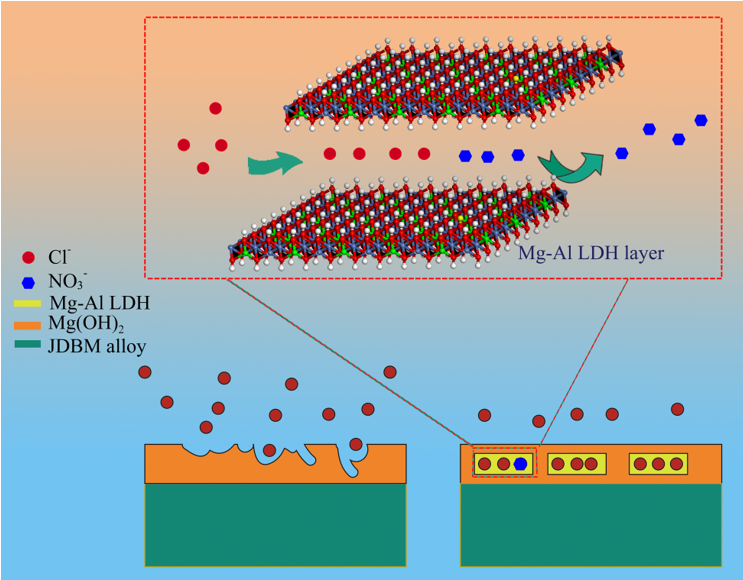
图3 Mg-Al LDH提高镁合金表面抗腐蚀性机制
受“花瓣效应”的启发,利用Mg-Al LDH结构在镁合金表面构建超疏水且具有高粘附力的涂层(Sci. China Mater., 2017, 61 (4),629-642)。涂层表面的片状微纳结构和低表面自由能的油酸根赋予涂层超疏水性。水滴与涂层表面之间封存的空气以及固液界面间范德华力,使水滴在涂层表面显示出高粘附性(即使倒置180°,水滴也不会从材料表面脱落)(图4)。细胞毒性、细胞迁移以及细胞粘附等结果都表明超疏水涂层具有良好的细胞相容性。溶血率和血小板粘附测试表明超疏水涂层的血液相容性也有明显提升。
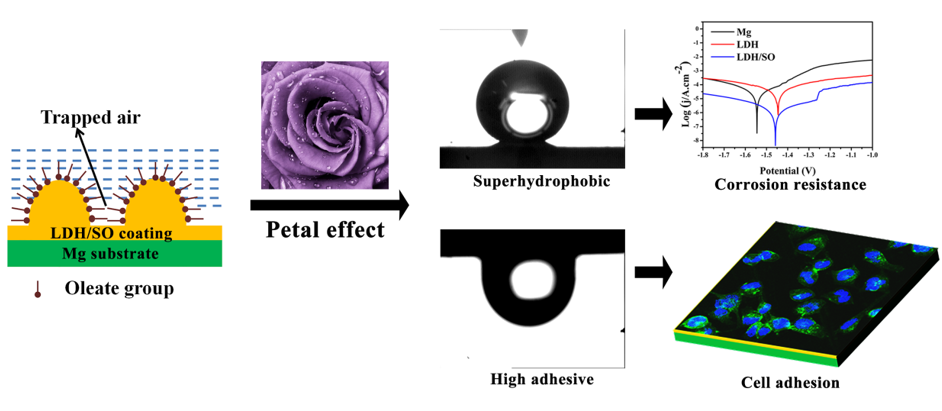
图4. 超疏水高粘附力涂层提高镁的抗腐蚀性和生物相容性
采用两步法在PEO涂层上制备了不同Fe含量的Mg-Fe LDH薄膜: 即先将覆盖有PEO MgO涂层的样品浸泡在含有Fe2+的溶液中制备一层FeOOH薄膜,然后将该MgO-FeOOH涂层在纯水中进行水热处理而转化得到PEO/Mg-Fe LDH复合涂层。电化学测试、析氢和腐蚀形貌结果表明,高取向LDH纳米片可以提高PEO涂层的耐蚀性能,且PEO/Mg-Fe LDH复合涂层的溶血率显著低于PEO涂层(小于5%)。此外,PEO/Mg-Fe LDH涂层比PEO涂层更有利于细胞的粘附和增殖。有趣的是,PEO/Mg-Fe LDH涂层具有良好的光热转换性能,在近红外光下表现出良好的快速抗菌效果。另外,PEO/Mg-Fe LDH涂层的浸提液促进了大鼠骨髓干细胞(rBMSC)的成骨活性(图5)。大鼠体内皮下植入实验表明,PEO/Mg-Fe LDH涂层具有良好的耐蚀性和组织相容性(Journal of materials science and technology, 2022, 105, 57-67)。
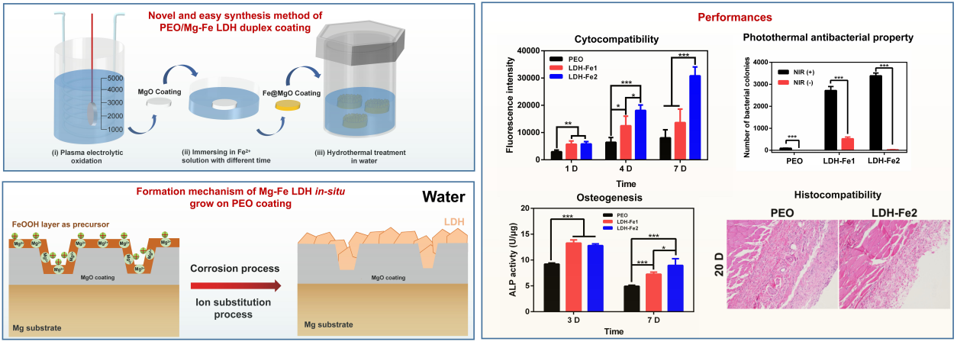
图5. PEO/MgFe LDH复合涂层的工艺、机理及性能示意图
此外,我们在镁合金表面制备了一种黑色含锰层状双氢氧化物(Layered doubled hydroxides, LDH)纳米片涂层修饰镁基植入体。该黑色LDH涂层含有二价锰和三价锰,从而表现出良好的过氧化物酶活性,可以有效催化肿瘤组织高表达的过氧化氢产生活性氧(ROS)。此外,涂层呈黑色而具有较强的光吸收能力,可较强的吸收近红外光并将其转换为热能。得益于所构建的黑色LDH涂层较好的光热转换性能和在肿瘤特定微环境中生成活性氧(ROS)的能力,该植入体可以有效地消融肿瘤细胞和组织。同时,也可通过局部热疗杀死细菌。此外,构建的黑色LDH显著增强了镁基植入物的耐腐蚀性,并可有效释放锰和镁离子,这种协同作用显著促进了成骨细胞粘附、铺展和增殖并加速了体内骨再生(图6)。这项工作为骨肉瘤治疗和骨缺损修复提供了一个新的平台和可行的策略,并拓宽了镁基合金的生物医学应用(Bioactive materials, 2022, 7, 394-405)。
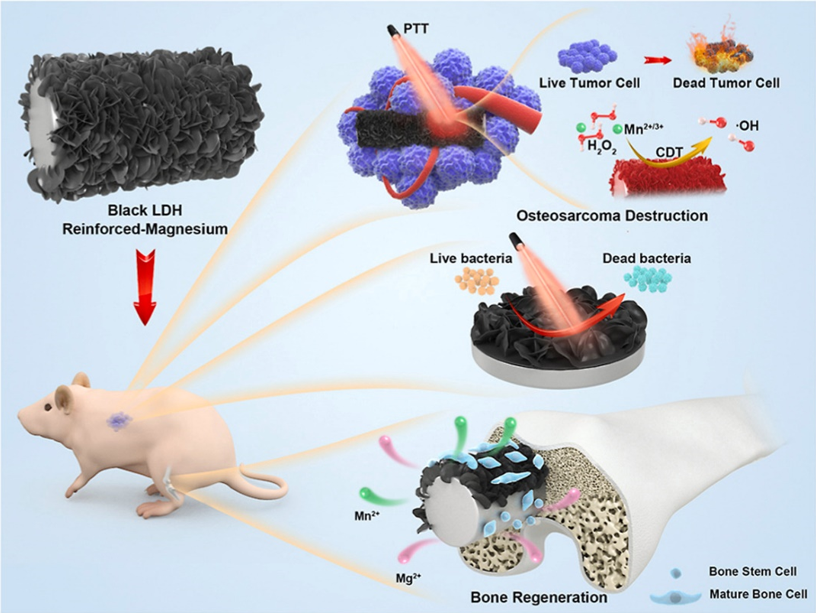
图6. 黑色锰基LDH修饰的镁合金抗肿瘤、抗菌成骨示意图
根据 “生物可降解”、“腐蚀控制”、“生物相容性”和“生物功能化”四个评价标准,LDH涂层有望实现镁及其合金腐蚀保护和功能化改性。基于此,我们设计了一个系统的对比和优化设计实验(图7)。以羟基氧化物作为前驱体在PEO处理的镁合金表面制备了过渡金属基Mg-M (M=Mn、Fe、Co) LDH涂层,对比研究了它们的物理化学性能、耐腐蚀性、生物相容性、抗菌及抗肿瘤能力。结果表明,元素M含量相似的情况下,Mg-Mn LDH涂层表现出较优的耐腐蚀性;此外,Mg-Mn和Mg-Co LDH涂层表现出良好的光热转换性能和响应过氧化氢产生活性氧的能力;Mg-Fe LDH涂层具有最好的生物相容性和抗菌能力。基于此,构建了表层富Fe、内层富Mn的双相梯度Mg-Fe/Mn LDH复合涂层。复合涂层具有良好的耐腐蚀性、生物相容性、光热抗菌、光热/催化抗肿瘤和成骨性能。
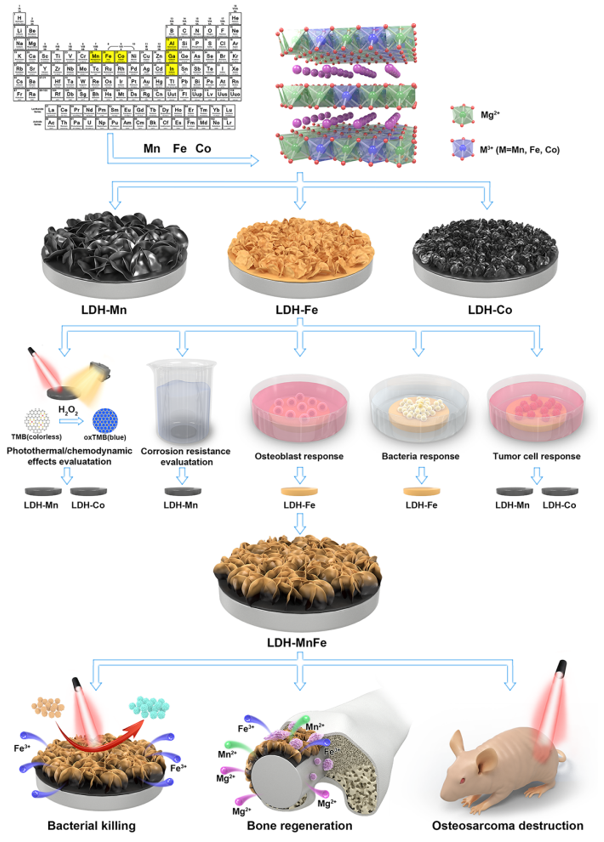
图7. 黑色锰基LDH修饰的镁合金抗肿瘤、抗菌成骨示意图
3. 纯镁表面镓基引导骨再生涂层构建
结合微弧氧化和水热处理,团队在纯镁表面构建具有耐腐蚀、抗菌和促成骨性能的镁-镓层状双氢氧化物(Mg-Ga-LDH)涂层(图7a,J. Materiomics, 2025, 11(6): 101071)。该涂层具备良好的致密性与耐腐蚀性能,能调控镁的降解速率,释放适量镁、镓离子,并维持弱碱性微环境,有助于提升其促成骨性能和局部抗菌能力。为进一步增强抗菌效果,团队引入金属多酚网络,在纯镁表面构建双金属多酚涂层(Mg-Ga-Q,图7b),利用金属离子与去质子化多酚的配位作用,增强涂层稳定性和协同抗菌效果。该涂层在体内外实验中表现出良好的成血管与骨修复能力。

图7. (a)纯镁表面Mg-Ga-LDH涂层构建示意图;(b)纯镁表面Mg-Ga-Q涂层构建示意图。


 沪公网安备 31010502006565号
沪公网安备 31010502006565号