诊疗纳米医学(Theranostic nanomedicine)是纳米生物医学研究领域中一个新兴的重要分支,这种以多功能纳米诊疗剂构建的集医学诊断和原位治疗于一体的新技术,有望在未来人类重大疾病的诊断和治疗中发挥重要作用,是当前国际研究的热点和前沿领域。近年来,基于稀土化合物的上转换发光纳米颗粒(UCNPs)作为一种新型的多功能纳米诊疗剂,具有近红外光激发、上转换发光(UCL)成像、磁共振成像(MRI)等功能优势,在肿瘤的多模式影像诊断和高效治疗中的应用基础研究倍受关注。
中国科学院上海硅酸盐研究所施剑林研究员带领的介孔与低维纳米材料课题组,长期从事无机功能纳米材料的化学制备及生物学应用研究。最近,该课题组围绕如何实现癌症的高效诊断和治疗这一主题,开展了一系列富有成效的研究探索,在基于UCNPs的多功能诊疗剂研究中取得了一系列重要创新进展。首先,针对如何提高钆掺杂造影剂(Gd-UCNPs)的UCL/MRI双模式成像性能,构建了具有不同体相钆和表面钆分布密度的三种结构模型,澄清了体相钆和表面钆在T1-MRI性能上的争议,并首次提出了在无机Gd-UCNPs造影剂中上转换发光和磁共振成像存在着“正负晶格屏蔽效应”(Adv. Funct. Mater. 2011, 21, 4285-4294)。在此基础上,通过构建多种表面修饰的Gd-UCNPs,进一步阐明了无机Gd-UCNPs造影剂的T1-MRI磁共振成像机理,在机理指导下,通过同时优化Gd-UCNPs内核结构以及表面修饰,获得了目前基于该类材料报道的最高r1值(达到14.73 mM-1s-1);同时,证实了所制备的Gd-UCNPs纳米探针在小鼠活体内具有优良的UCL/T1-MR双模式成像功能(Adv. Funct. Mater. 2013, 23, 298-307)。
在此基础上,他们系统开展了基于UCNPs的肿瘤多模式造影剂及其生物学效应研究。综合考虑不同成像模式在空间分辨率、成像深度和应用领域中各自的优势,借助于金颗粒(Au)的高X射线衰减吸收系数,他们将粒径为1-2 nm的Au纳米颗粒嫁接于NaYF4:Yb/Gd/Er/Tm@SiO2表面形成“芝麻球”状的多模式成像探针,在小鼠肿瘤区域实现了UCL/MR/CT多模式成像探测(Biomaterials 2012, 33, 1079-1089)。为了提高探针的多模式成像性能和生物相容性,他们进一步发展了NaYF4:Yb/Er/Tm@NaGdF4@TaOx核壳结构纳米探针,TaOx外壳不仅提供优异的生物相容性,而且TaOx本身即是优良的CT成像造影剂(Biomaterials 2012, 33, 7530-7539)。为了进一步考察多模式探针在活体内的分布、代谢及组织毒性等,他们设计和制备了Yb-UCNPs多功能纳米探针(NaYbF4: Tm),该探针无需任何功能化即可实现高的上转换发光和CT成像性能(比临床用碘剂提高一倍);系统研究其在体内的分布、代谢及组织毒性后发现,该纳米探针具有良好的生物相容性(Biomaterials 2012, 33, 5384-5393)。
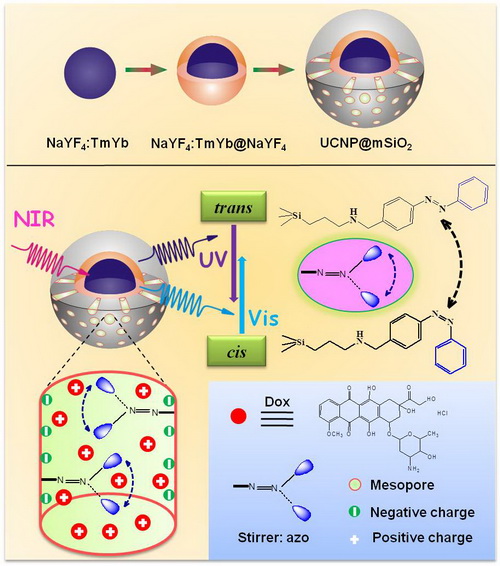
在基于UCNPs的肿瘤多模式影像诊断的基础上,他们又系统研究了多种基于UCNPs的多功能诊疗剂在肿瘤化疗、放疗及多模式联合协同治疗上的应用。考虑到很多抗癌药物通过破坏核内DNA的作用机制,他们设计并成功制备了兼具宫颈癌高效细胞核直接给药和细胞核实时UCL/MRI双模式成像的超小尺寸(~35 nm)多功能纳米诊疗剂;与传统纳米诊疗体系细胞质输运相比,这种新型纳米诊疗体系可以将破坏DNA结构的抗癌药物直接输送至细胞核中的靶点周围,显著提高了药物的利用度及疗效(Biomaterials 2012, 33, 7282-7290)。在此基础上,为了使化疗药物可控释放,并降低其在生物体内的毒副作用,他们设计和制备了具有核壳结构的多功能纳米诊疗剂(NaYF4:Yb/Tm@NaYF4@mSiO2),借助于近红外光(980 nm)激发下UCNPs发出的紫外/可见光,使介孔孔道内光敏剂偶氮苯发生连续的旋转-翻转运动,从而实现了对生物组织具有高穿透深度的近红外光照下的可控药物释放,避免了传统紫外光对生物组织的毒副作用(Angew. Chem. Int. Ed.2013, 52, 4375-4379)。
在肿瘤化疗研究的基础上,他们又进一步发展了一种基于双重金属的UCL/CT双模式探针(BaYbF5: Er/Tm),该探针具有体内血液半衰期长、CT造影成像性能优异的特点,并具有高效主动靶向胶质瘤的CT成像性能。借助于探针中重金属Ba和Yb对X射线的光电效应以及电子对效应,使探针周围的光电子、自由基和X射线的剂量得到有效增加,从而实现了活体肿瘤区域的放射治疗增敏,显著提高了放疗效果(Scientific Reports, 2013, DOI: 10.1038/srep01751)。
为了实现化疗/放疗协同治疗,他们通过多步化学反应,成功合成了100 nm以下,具有空腔结构的NaYF4:Yb/Er@NaGdF4@hmSiO2多功能纳米诊疗剂。内核UCNPs(NaYF4:Yb/Er@NaGdF4)可用于UCL/T1-MR双模式成像,外壳二氧化硅空腔可高效装载抗癌药物顺铂。顺铂既可以作为化疗药物,杀死肿瘤细胞,又可以作为放疗增敏剂,增强X射线对乏氧肿瘤的杀伤作用,从而提高放疗效果。系统的研究结果表明,放/化协同治疗效果明显优于任何一种单一模式或两种单一模式的加和治疗效果,从而达到协同高效治疗的目的(J. Am. Chem. Soc.2013, 135, 6494-6503)。
上述研究成果得到了国家科技部973计划、国家自然科学基金、上海市启明星跟踪计划、上海市“科技创新行动计划”纳米科技专项和上海市人才发展资金的支持。

《美国化学会志》期刊中的题图
《德国应用化学》期刊中的题图
发表的系列学术论文见以下链接:
http://www.nature.com/srep/2013/130429/srep01751/full/srep01751.html
http://pubs.acs.org/doi/abs/10.1021/ja312225b
http://onlinelibrary.wiley.com/doi/10.1002/anie.201300183/abstract
http://onlinelibrary.wiley.com/doi/10.1002/adfm.201201469/abstract
http://onlinelibrary.wiley.com/doi/10.1002/adfm.201101663/abstract
http://dx.doi.org/10.1016/j.biomaterials.2012.04.002
http://dx.doi.org/10.1016/j.biomaterials.2012.06.028
http://dx.doi.org/10.1016/j.biomaterials.2012.06.035
http://dx.doi.org/10.1016/j.biomaterials.2011.10.039
高性能陶瓷和超微结构国家重点实验室


 当前位置:
当前位置:

