恶性肿瘤通常存在免疫抑制的微环境,容易转移复发,一直是困扰医学界的一大难题,严重危害人民生命健康。近年来,基于内外源刺激响应的功能纳米载体引起了研究者的广泛关注,有望为更安全、更高效地恶性肿瘤治疗提供新的策略。
近日,中国科学院上海硅酸盐研究所陈航榕研究员带领的多孔与纳米功能材料课题组在多种智能响应型功能纳米诊疗体系的创新构建方面取得系列进展,并成功应用于多种恶性肿瘤模型的高效治疗。胰腺癌因其存在致密的纤维化间质、间质液压力升高和血管不足等因素,严重阻碍了大分子类蛋白药物或其他类型治疗药物扩散深入肿瘤组织。为解决这一难题,研究团队采用微流控技术可控设计合成了一种可响应肿瘤微环境,同时可实现肿瘤深部药物递送的智能化纳米载药系统ZIF-DOX/RA@DG。该纳米载药系统由负载化疗药物DOX和蛋白药物RNase A的ZIF内核,以及可响应γ-谷氨酰转移酶(GGT)实现电荷转变和响应pH实现药物可控释放的外壳DG组成。当该纳米载药系统进入肿瘤区域,由于肿瘤微环境中高表达的GGT,使得纳米颗粒表面电位由负变正,促进细胞内吞和转胞吞作用,将所负载的化疗药物DOX和蛋白药物RNase A递送到肿瘤深部;同时伴随着内核ZIF和外壳DG在肿瘤弱酸性环境中的响应降解而释放药物,实施精准的肿瘤区域多药协同抗肿瘤效果。该研究为利用微流控技术制备有机/无机杂化纳米载药系统和有效促进大分子蛋白类药物的肿瘤深部递送,实现精准高效的肿瘤治疗提供了有益的参考。相关研究工作以“Microfluidics-Assisted Engineering of pH/Enzyme Dual-Activatable ZIF@Polymer Nanosystem for Co-Delivery of Proteins and Chemotherapeutics with Enhanced Deep-Tumor Penetration”为题发表在Angewandte Chemie International Edition期刊上。该论文第一作者为上海硅酸盐所2017级博士生申杰,通讯作者为陈航榕研究员和马明副研究员。
免疫抑制肿瘤微环境(TME)由于抗原呈递细胞(APC)呈递效率低,细胞毒性T淋巴细胞(CTLs)浸润不足,促肿瘤表型肿瘤相关巨噬细胞(M2)高表达,调节T细胞(Tregs)大量浸润等特点被认为是引发肿瘤转移和复发问题的根源之一。同时肿瘤组织的乏氧环境又将进一步促进免疫抑制TME,导致抗肿瘤免疫效果低下。为解决这一问题,研究团队通过溶胶凝胶-水热法制备得到聚乙烯吡咯烷酮(PVP)修饰的p-n型BiFeO3/Bi2WO6异质结纳米颗粒(BFO/BWO-PVP NPs)。BFO/BWO-PVP NPs在660 nm激光照射下激活并诱导空穴-电子分离,与水和氧气分别反应产生羟基自由基(·OH)和超氧阴离子(·O2-),用于I型光动力治疗(PDT)。同时空穴触发肿瘤组织过表达的H2O2分解产生氧气,氧气不仅增强·O2-产生也能增敏放疗(RT)。此外,氧气的产生还能缓解肿瘤组织乏氧,降低乏氧诱导因子(HIF-1a)的表达,进一步诱导肿瘤相关巨噬细胞向M1表型极化。通过免疫相关表征证实:BFO/BWO-PVP NPs介导的PDT/RT能够有效促进树突细胞(DCs)成熟,提高抗原呈递并募集CTLs细胞于肿瘤组织的大量浸润,同时诱导肿瘤相关巨噬细胞M1表型大量表达。这种光激活的纳米平台联合RT将免疫抑制TME逆转为免疫激活TME,显著抑制4T1原发瘤和转移瘤的生长,同时增强了针对复发肿瘤的长期免疫记忆。该研究对耐药、易复发转移型恶性肿瘤的临床治疗提供了有益参考。相关研究工作以“Reshaping Tumor Immune Microenvironment Based on Light Activated Nano-Platform for Efficient Cancer Therapy”为题发表在Advanced Materials期刊上。该论文第一作者为上海硅酸盐所与同济大学联合培养博士生杨泽斌,通讯作者为陈航榕研究员和复旦大学附属华山医院放射科尹波教授。
此外,研究团队采用一步水热法合成具有低结晶度、尖晶石结构的介孔CuFe2O4纳米晶,该纳米晶在磁场作用下表现出良好的磁热转换性能可用于磁热治疗(MHT),同时利用肿瘤弱酸性微环境中Cu2+和Fe3+之间的自循环氧化还原能力并结合磁热升温促进作用,有效克服了传统铁基芬顿试剂产·OH效率低的问题,实现MHT-CDT的协同作用。进一步利用介孔结构负载自噬抑制剂,通过阻止自噬小体与溶酶体的融合来抑制癌细胞的自噬,有效提高癌细胞对协同MHT-CDT的敏感性。这种基于单组分多功能纳米载体用于实施抑制自噬增效温和MHT与CDT协同治疗策略在活体肿瘤模型上实现了良好的治疗效果,为设计创新的纳米抗肿瘤药物提供了新思路。相关研究工作以“Self-cycling redox nanoplatform in synergy with mild magnetothermal and autophagy inhibition for efficient cancer therapy”为题发表在Nano Today期刊上。该论文第一作者为上海硅酸盐所2019级硕士研究生王淼,通讯作者为陈航榕研究员和同济大学附属第十人民医院陈潜博士后、张扬副研究员。
相关链接:
Angew. Chem.论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202113703
Adv.Mater.,论文链接:https://doi.org/10.1002/adma.202108908
Nano Today论文链接:https://authors.elsevier.com/a/1eP4w6DSyBAFMJ
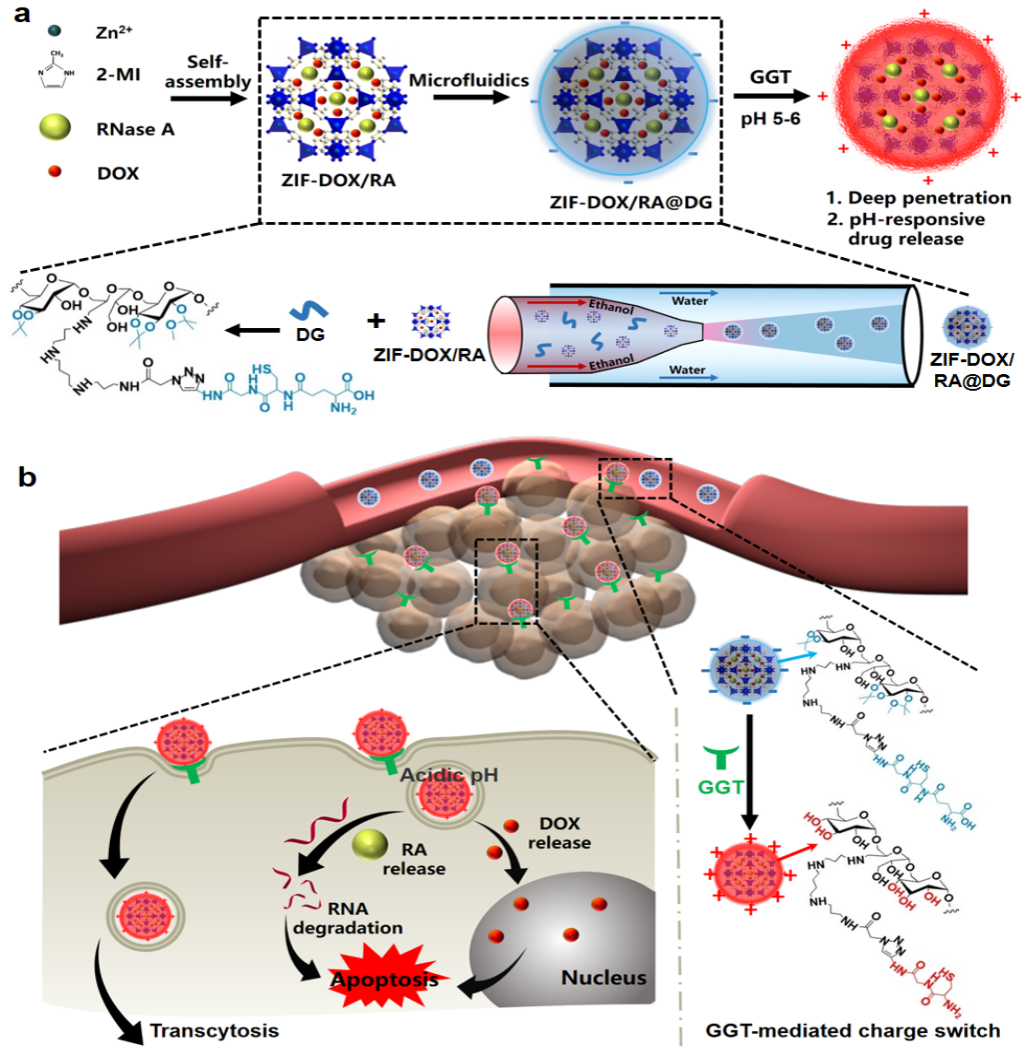
PH/酶双响应纳米智能递药系统构建及其肿瘤深部递送DOX/RA药物的示意图
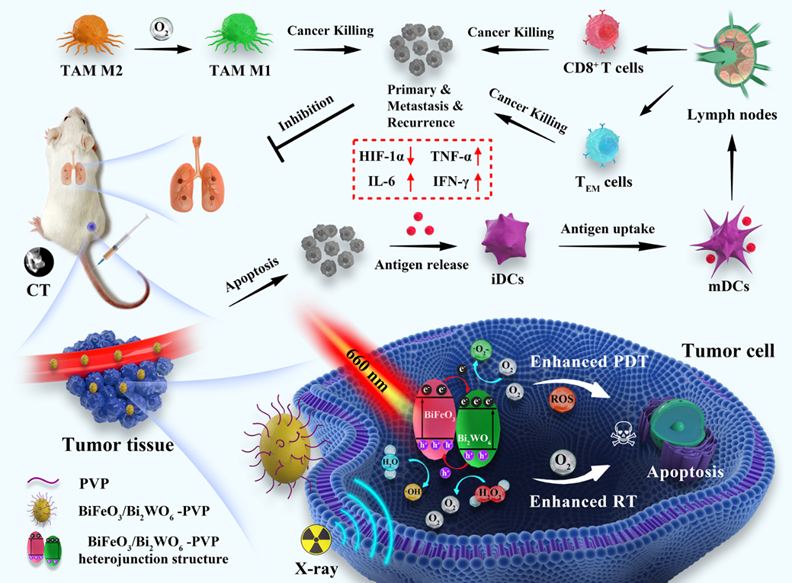
光激活智能响应纳米平台逆转肿瘤免疫抑制微环境实现高效肿瘤模型治疗示意图


 沪公网安备 31010502006565号
沪公网安备 31010502006565号