天然的组织由种类繁多的体细胞构成。这些细胞在三维空间上有序排列,形成复杂的3D微环境。不同细胞之间的串扰可以显著调节它们各自的增殖、迁移和分化行为。此外,组织细胞在三维空间上的分布也会对它们的行为和命运产生深远的影响。基于这些关键的发现,目前已经有许多研究尝试制备各种多细胞组织工程支架以期能够重现复杂的3D细胞生态位。然而,在早期许多关于多细胞支架的研究中,研究者们仅仅以无序的方式将多种细胞简单混合在一起。这种无序混合的方式使得研究者很难精准地研究各种细胞间的相互影响以及单种细胞在共培养系统中的贡献。随着技术的发展,微流控技术以及生物打印技术的出现,使得精准调控多种细胞在三维空间上的分布成为可能。然而,微流控技术构建的多细胞共培养模型无法作为植入物用于体内实验验证。而生物打印技术的材料选择局限于水凝胶等软材料。并且在分离细胞用于研究单种细胞的贡献时,往往需要使用细胞分选磁珠。这种方法过程繁琐且成本高昂。因此,考虑到以上诸多问题,构建一种具有广泛适用性的多功能多细胞组织工程支架仍然具有挑战性。
针对这些问题及挑战,中国科学院上海硅酸盐研究所吴成铁研究员带领团队提出将模块化组装策略与3D打印技术相结合,制备出了可组装/拆卸的模块化支架用于复杂多细胞组织再生。该研究首先利用光固化3D打印技术制备各种支架模块,然后将担载不同细胞的模块组装成具有模块化空间结构的支架用于复杂多细胞组织再生。在实验中,通过改变模块的宏观结构设计、打印浆料的原料可以很容易制备出具有定制化结构、基于多种材料体系的模块化支架。此外,模块化支架的可拆卸属性使得研究者可以深入研究每种细胞类型在多细胞共培养系统中的具体贡献。这种模块化空间结构支架在许多领域展现出广泛的适用性,包括复杂组织工程、多细胞串扰研究以及药物筛选。
在体外细胞实验中,基于模块化组装的策略,研究者们成功构建了软骨细胞-间充质干细胞、巨噬细胞-间充质干细胞以及内皮细胞-间充质干细胞三种多细胞共培养模型。细胞实验结果表明模块化支架可以为各种组织细胞间的串扰创造一个有益的微环境。各种细胞间的串扰能有效促进这些细胞的增殖和分化行为。并且,模块化支架上的骨髓间充质干细胞可以通过调控NFAT相关信号通路进一步影响软骨细胞的行为,证明骨髓间充质干细胞可以通过旁分泌调控软骨细胞的行为及命运。此外,体内动物实验表明装载软骨细胞-骨髓间充质干细胞共培养系统的模块化支架可以提供一个有益的仿生微环境,从而促进骨软骨组织的一体化修复。这种可组装/拆卸的模块化支架为多细胞组织工程的发展提供了一种新思路。
该研究成果以“Assembled/Disassembled Modular Scaffolds for Multicellular Tissue Engineering”为题近日发表在Advanced Materials期刊上(Adv. Mater. 2024, 36, 2308126),并申请了一项发明专利。论文的第一作者为上海硅酸盐所2018级直博生喻小鹏,通讯作者为吴成铁研究员。相关研究得到了国家重点研发计划、国家自然科学基金、中国科学院稳定支持基础研究领域青年团队计划等基金的资助。
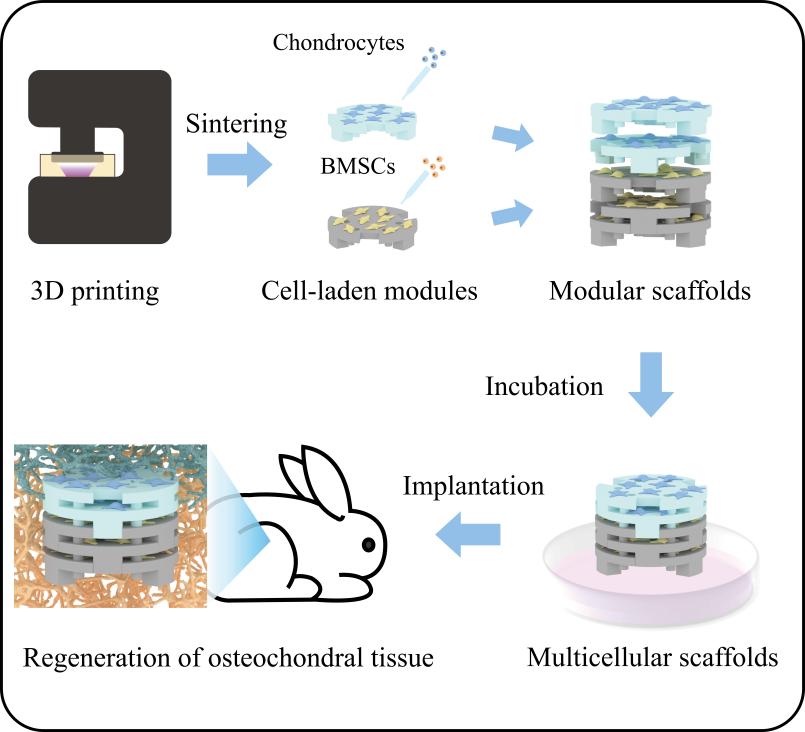
图1.可组装/拆卸的模块化生物陶瓷支架用于多细胞组织工程

图2. 3D打印可组装/拆卸的模块化生物陶瓷支架的示意图、照片及三维重建模型。(A)由圆形模块组装成的模块化支架。(B)由方形模块组装成的模块化支架。(C)具有汉诺塔结构的模块化支架。(D)模块化生物陶瓷支架是由5层3D打印的圆形模块组装而成。(E)3D打印的方形模块可以被组装成不同的尺寸的生物陶瓷支架。(F)具有汉诺塔结构的模块化支架是由不同直径的圆形模块组装而成。(G)3D打印的支架模块可以被组装成定各种制化结构,比如“SIC”(上海硅酸盐所简称)。(H,I)圆形模块化支架的Micro-CT重建模型。
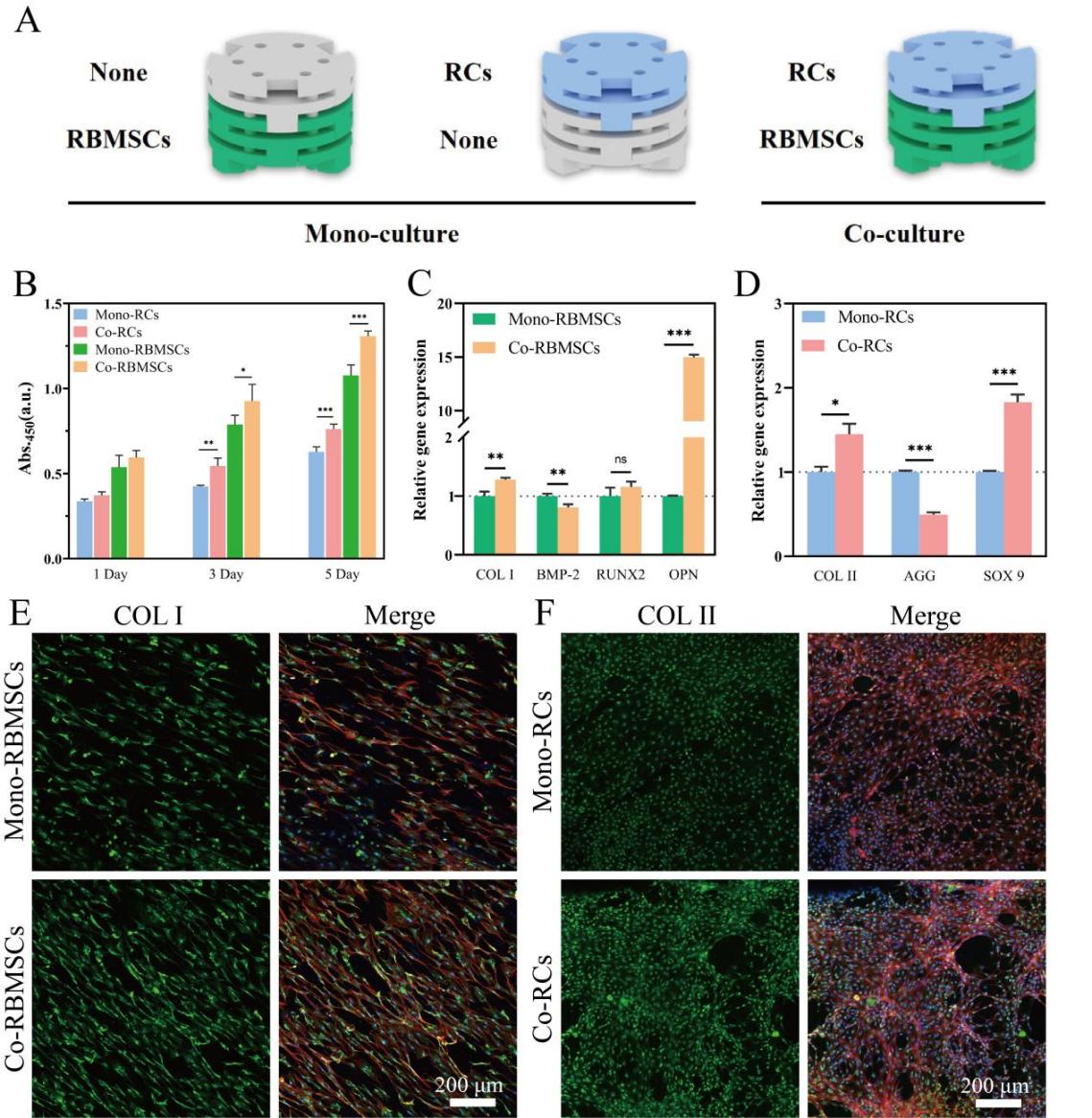
图3.装载软骨-骨髓间充质干细胞共培养系统的模块化支架用于骨软骨组织再生。(A)装载软骨-骨髓间充质干细胞单培养及共培养系统的模块化支架的示意图。(B)软骨-骨髓间充质干细胞在单培养及共培养系统中的增殖活力。(C)骨髓间充质干细胞在单培养及共培养系统中表达的成骨相关基因水平。(D)软骨细胞在单培养及共培养系统中表达的软骨成熟相关基因水平。(E)不同组中骨髓间充质干细胞内COL-I的免疫荧光图像。(F)不同组中软骨细胞内COL-II的免疫荧光图像。
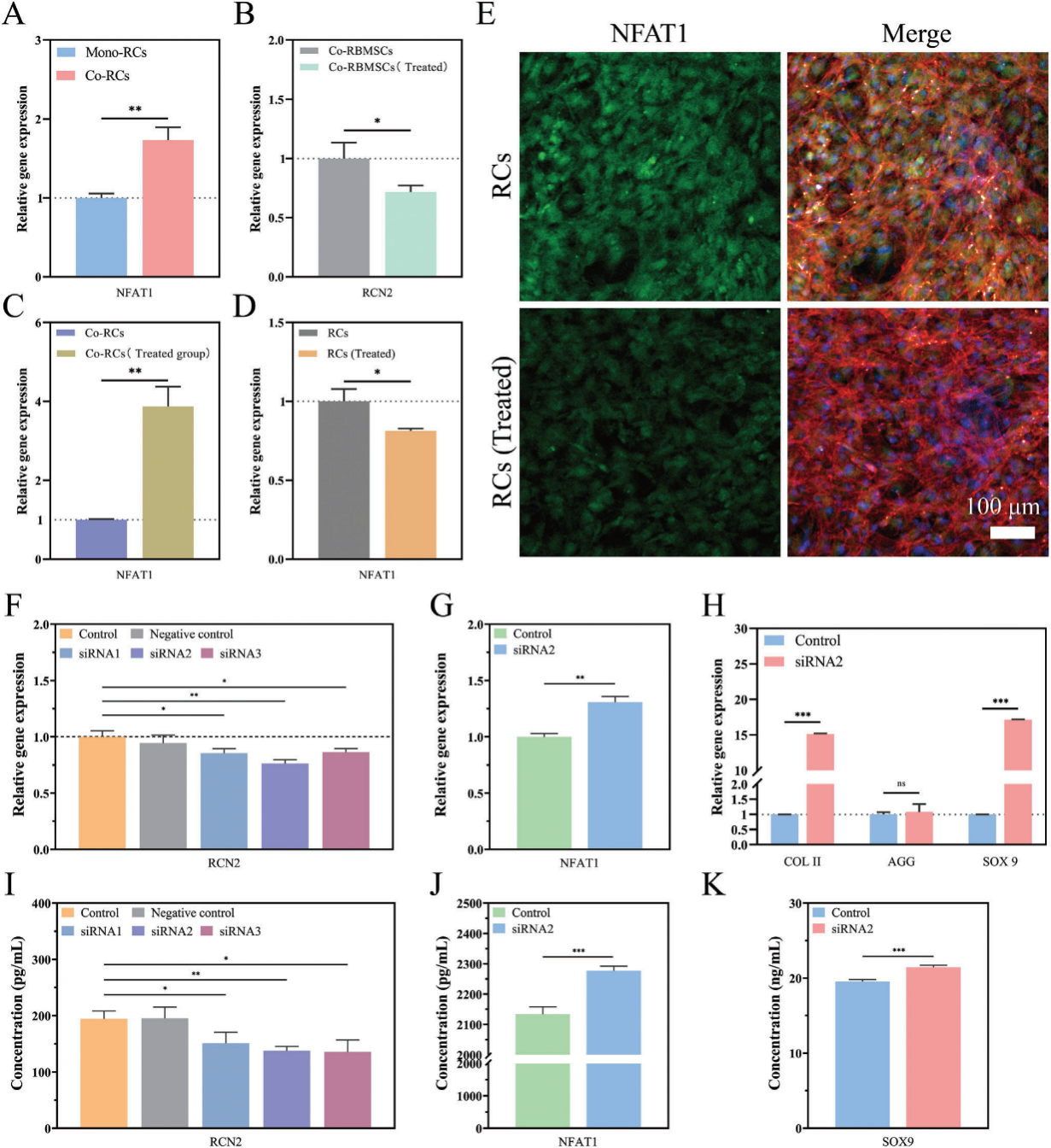
图4. 骨髓间充质干细胞对软骨细胞影响的机制研究。(A)软骨-骨髓间充质干细胞共培养组中软骨细胞表达的NFAT1基因显著上调。(B)经普卡霉素处理后,软骨-骨髓间充质干细胞共培养组中骨髓间充质干细胞表达的RCN2基因显著下调。(C)在与MTM处理的骨髓间充质干细胞共培养后,软骨细胞表达的NFAT1基因显著上调。(D)经RCN2蛋白处理后,软骨细胞表达的NFAT1基因显著下调。(E)不同组中软骨细胞内NFAT1的免疫荧光图像。(F)经siRNA处理后,软骨细胞内的RCN2基因被敲低。(G)经siRNA处理后,软骨细胞内的NFAT1基因表达上调。(H)经siRNA处理后,软骨细胞成熟相关基因(COL II、SOX9)的表达显著上调。(I)经siRNA处理后,软骨细胞内的RCN2蛋白表达下调。敲低RCN2可促进NFAT1 (J)和SOX9 (K)蛋白的表达。
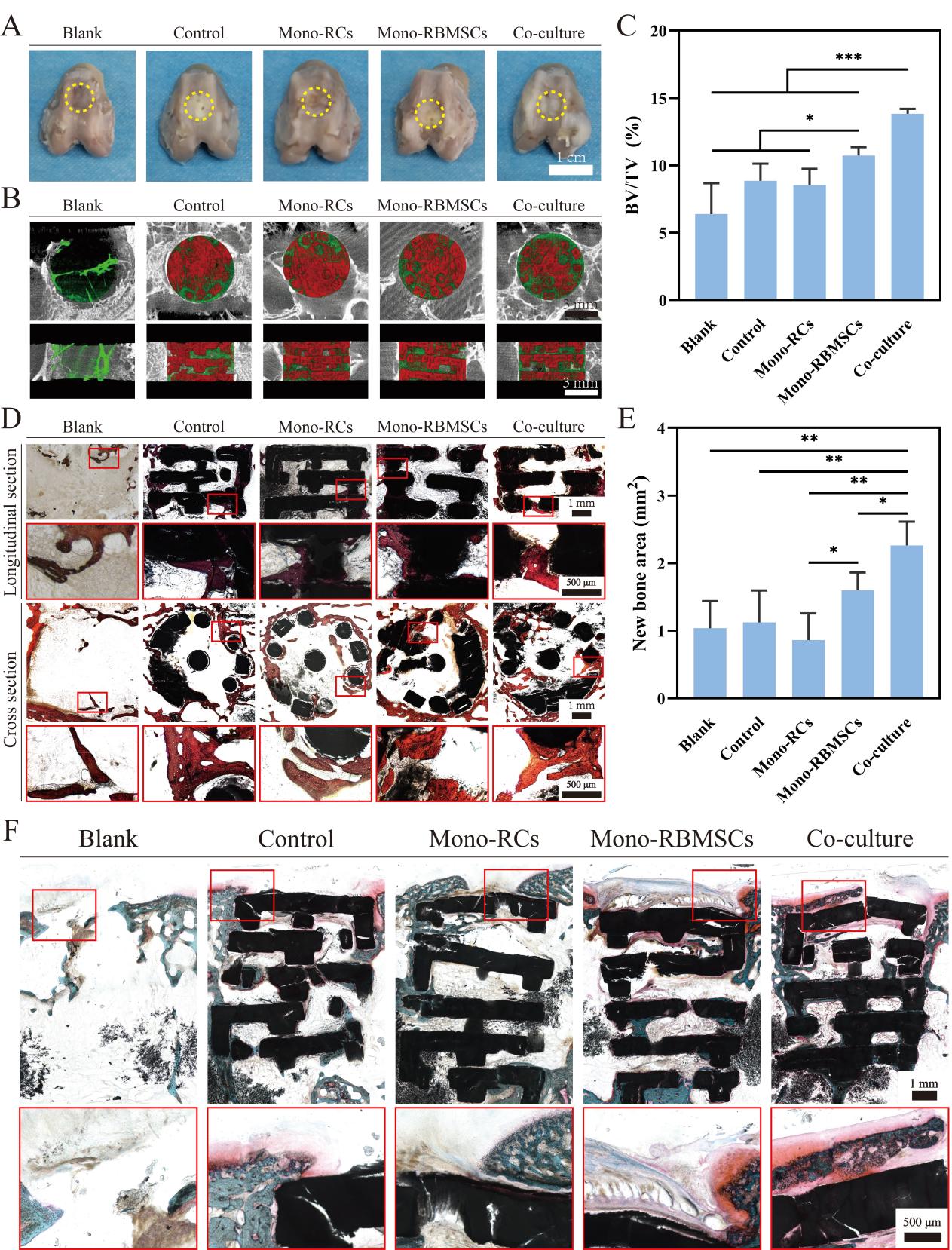
图5. 装载软骨细胞及骨髓间充质干细胞的模块化支架用于体内骨软骨组织再生。(A)术后8周取材的兔子股骨照片。(B)支架(红色)及新生骨组织(绿色)的横切面及纵切面的Micro-CT图像。(C)新骨体积在缺损部位总体积中占比的统计分析。(D)术后8周不同组中新生骨组织的Van-Gieson染色。(E)不同组中新生骨组织面积的统计分析。(F)术后8周不同组中新生软骨的番红固绿染色切片。


 沪公网安备 31010502006565号
沪公网安备 31010502006565号