介孔氧化硅纳米颗粒(MSNs)具有大的比表面积、高的孔容、均匀可调的孔径、易于化学改性的内外表面以及良好的生物相容性,在诸如药物输运、基因治疗、生物传感器、分子影像、组织工程等纳米生物技术领域显示出良好的性能与广阔的应用前景。近些年来,介孔氧化硅纳米颗粒还被广泛地用作分子药物或者功能材料的载体,用于各种重大疾病尤其是肿瘤的高效诊断和治疗。
近期,中国科学院院士、中国科学院上海硅酸盐研究所施剑林研究员课题组结合十多年来在“介孔氧化硅纳米颗粒的生物医学应用”和“纳米催化医学”两方面的研究特色,提出了利用金属-配体相互作用增强纳米催化肿瘤治疗的新策略。研究团队构建了多种金属元素掺杂的空心介孔氧化硅纳米颗粒并用其负载有机分子药物,通过在肿瘤区域诱发配位和催化反应,以实现肿瘤的纳米催化治疗。由于金属元素在介孔氧化硅骨架中对肿瘤的酸性环境较为敏感且容易被氢离子替换出来,纳米颗粒便很容易在肿瘤区域降解,释放出金属离子和有机药物分子。这两者能够很快地发生配位反应,生成具有独特配位场的金属螯合物。由于金属-配体之间的协同作用,金属中心被有机配体“激活”并将氧气一步步催化转变为活性氧尤其是羟基自由基(·OH),杀死癌细胞,抑制肿瘤生长。
1. 负载抗坏血酸盐的铁掺杂的介孔氧化硅纳米颗粒用于肿瘤催化治疗
水果中富含抗坏血酸(维生素C)。抗坏血酸和抗坏血酸盐的氧化还原特性较为奇特。一方面它们被认为是一种优良的抗氧化剂,可以清除生物体内具有强氧化性的自由基;另一方面,临床研究证实抗坏血酸具有辅助性的抗肿瘤效果,抗坏血酸和抗坏血酸盐的促氧化性能被发现并受到关注。在过渡金属催化剂如Fe3+的存在下,抗坏血酸和抗坏血酸盐可以将氧气还原成活性氧如过氧化氢(H2O2),而H2O2在Fe3+存在的情况下又可以产生羟基自由基(·OH),因此显示出促氧化性能。基于此,研究团队通过构建铁掺杂的空心介孔氧化硅纳米颗粒(Fe-HMSNs),将抗坏血酸盐负载在空腔中,来实现对肿瘤的催化治疗(图1)。这种纳米载体具有较高的药物负载量,而其-Si-O-Fe-杂化骨架可以对肿瘤微环境进行响应,降解并释放出Fe3+和抗坏血酸盐,最终产生活性氧对肿瘤造成氧化损伤。该研究工作以“Ascorbate Tumor Chemotherapy by An Iron-Engineered Nanomedicine-Catalyzed Tumor-Specific Pro-Oxidation”为题发表在美国化学会志Journal of the American Chemical Society上(J. Am. Chem. Soc. 2020, 142, 21775-21785),并被选为封面文章。
2. 负载多巴胺的锰掺杂的介孔氧化硅纳米颗粒用于肿瘤催化治疗
多巴胺是一种重要的神经递质,参与调控中枢神经系统的多种生理功能。人的感知、注意力、运动以及一系列复杂的情感都和脑内多巴胺的分泌有关。多巴胺系统调节障碍涉及帕金森病, Tourette综合症等。锰中毒是造成神经系统多巴胺功能障碍的主要原因,因为锰离子(Mn2+)可以被多巴胺螯合,催化多巴胺的双电子氧化,并伴随两个连续的单电子氧还原反应(ORRs),生成过氧化氢(H2O2)和多巴胺醌,两者均可提高大脑氧化应激水平,对黑质正常神经细胞产生毒性。基于此催化反应过程,研究团队通过构建锰掺杂的空心介孔氧化硅纳米颗粒(Mn-HMSNs),将多巴胺负载在空腔中,来实现对肿瘤的催化治疗(图2)。由于纳米颗粒独特的尺寸效应,这种复合纳米药物不能穿越血脑屏障影响神经活动,却可以通过EPR效应优先在肿瘤区域富集,最终降解释放锰离子和多巴胺,通过配位反应和催化反应产生过氧化氢和多巴胺醌,前者可以进一步转化为羟基自由基,后者可以中和细胞内的谷胱甘肽,实现氧化物和还原物的双调节,增强对癌细胞的杀伤。该研究工作以“Nanomedicine-Leveraged Intratumoral Coordination and Redox Reactions of Dopamine for Tumor-Specific Chemotherapy”为题发表在中国化学会旗舰期刊CCS Chemistry上(CCS Chem. 2021, 3, 1648-1658)。
3. 负载没食子酸盐的铁掺杂的介孔氧化硅纳米颗粒用于肿瘤催化治疗
从中世纪到近现代,铁胆墨水(Iron Gall ink)一直在欧洲被广泛用于文件和音乐手稿的书写,承载着整个西方文化和艺术的发展。铁离子和没食子酸(GA)的反应是制备铁胆墨水的关键反应,生成六配位的GA-Fe纳米络合物。由于没食子酸盐的酚羟基和羧基均为给电子基团,因此在这种GA-Fe络合物中形成独特的还原性的配位场,使Fe中心具有部分二价铁的性质,可以诱发促氧化反应将O2一步步还原为H2O2,最终在酸性环境中可以通过类Fenton反应产生具有强氧化性的·OH,氧化纸张中的纤维素。因此,使用铁胆墨水书写的文物在保护的过程中很容易沿着墨水的痕迹发生腐蚀,这是文物保护中的一个大问题。雨果的全部作品和达芬奇的大部分作品的腐蚀和铁胆墨水这种独特的促氧化作用有很重要的联系。受此现象的启发,研究团队通过构建铁掺杂的空心介孔氧化硅纳米颗粒(Fe-HMSNs),将没食子酸盐负载在空腔中,来实现对肿瘤的催化治疗(图3)。这种复合纳米体系在肿瘤酸性环境中降解释放出Fe3+和没食子酸盐,原位合成GA-Fe纳米颗粒。在这种纳米络合物中,由于金属-配体之间的协同作用所形成的独特的配位场,电子在整个体系处于离域状态,可以诱发O2的两步连续的单电子还原反应产生过氧化氢,而二电子氧化后的GA-Fe纳米颗粒可以进一步把过氧化氢转变成羟基自由基,从而杀死癌细胞。该研究工作以“Intratumoral Synthesis of Nano-Metalchelate for Tumor Catalytic Therapy by Ligand Field-Enhanced Coordination”为题发表在自然·通讯Nature Communications上(Nat. Commun. 2021, 12, 3393. DOI: 10.1038/s41467-021-23710-y)。
以上三篇论文的第一作者均为上海硅酸盐所2017级直博生杨博文,导师为施剑林院士。相关研究工作得到了国家自然科学基金、中国科学院前沿科学重点研究计划、上海市政府科技项目的资助和支持。
论文链接:
https://pubs.acs.org/doi/10.1021/jacs.0c09984
https://www.chinesechemsoc.org/doi/10.31635/ccschem.021.202100930
https://www.nature.com/articles/s41467-021-23710-y
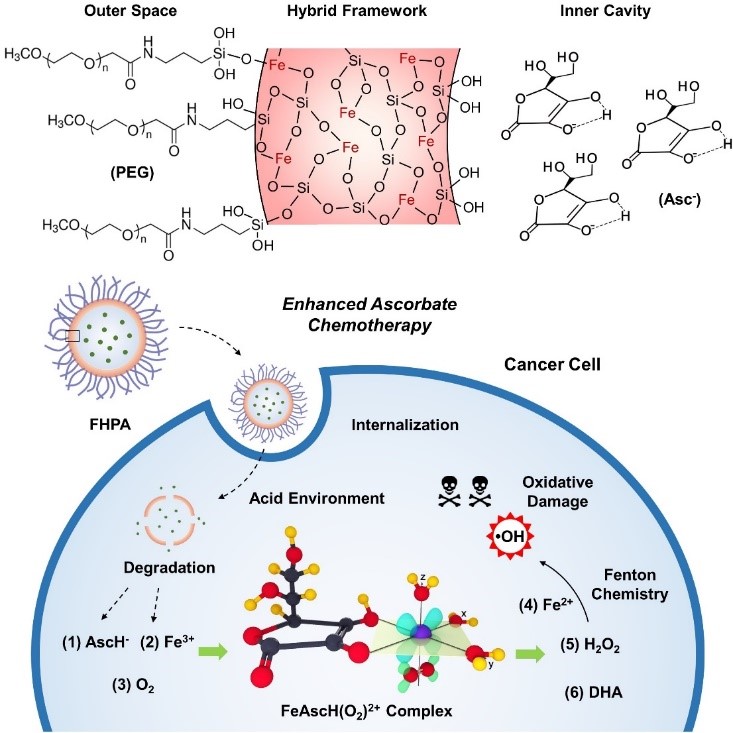
图1. 负载抗坏血酸盐的铁掺杂的介孔氧化硅纳米颗粒用于肿瘤催化治疗的原理示意图
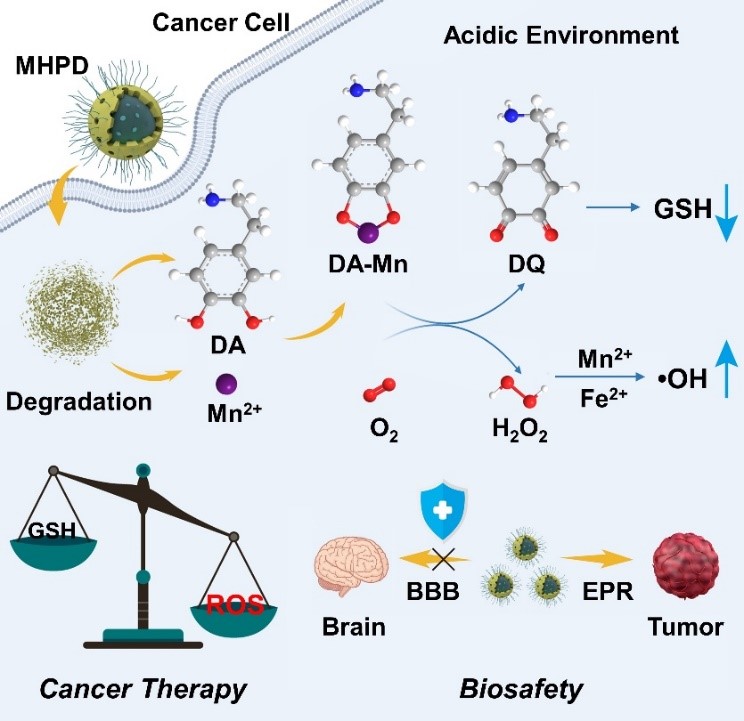
图2. 负载多巴胺的锰掺杂的介孔氧化硅纳米颗粒用于肿瘤催化治疗的原理示意图
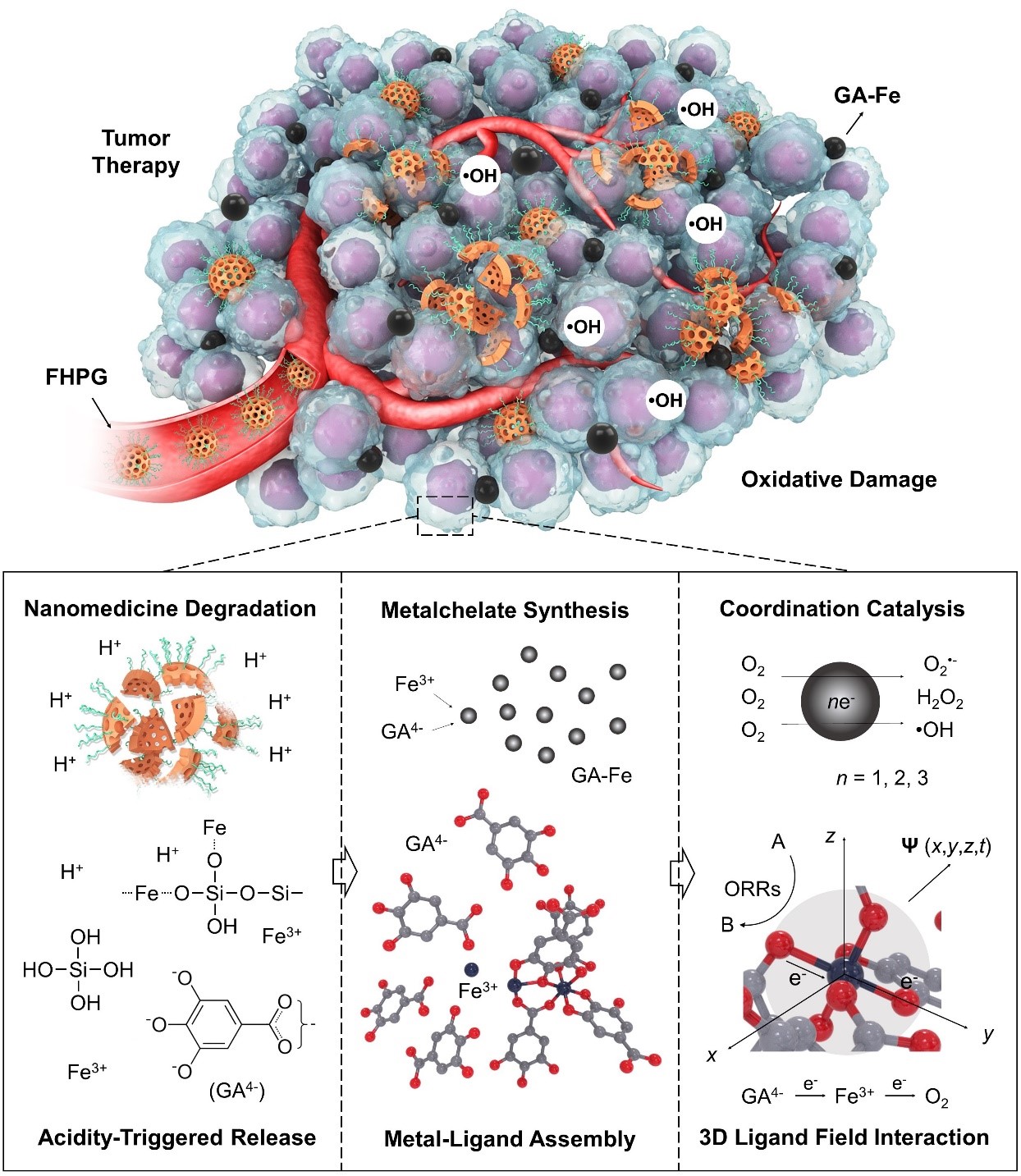
图3. 负载没食子酸盐的铁掺杂的介孔氧化硅纳米颗粒用于肿瘤催化治疗的原理示意图


 沪公网安备 31010502006565号
沪公网安备 31010502006565号