众所周知,癌症化疗中,需要使用高毒性的化疗药物。由于药物的非特异性,在杀死癌细胞的同时,同样杀死正常细胞,损害正常的组织和器官。事实上,70%以上的接受化疗的癌症患者,最后死于药物的毒性,以及癌细胞对药物的耐药性。
是否可以使用对正常细胞和组织无毒的纳米材料或分子,让这些材料或分子进入肿瘤后才产生毒性,或引起毒害作用?这样的想法如能成为现实,可以实现肿瘤的特异性治疗,同时从根本上避免化疗的毒副作用。
最近,中国科学院上海硅酸盐研究所施剑林研究员领导的团队,构想不用有毒生物化学药物实现肿瘤治疗,并通过对肿瘤内部氧组分或活性氧组分的调控,初步实现了这一构思。这为未来的无毒副作用的肿瘤化疗提供了可能。
起先采用的策略是基于目前的研究热点,光动力学疗法(Photodynamic Therapy, PDT)开展的。该方法利用无毒的光敏剂在紫外/可见光的作用下产生有毒的活性氧物种(ROS),以此杀死癌细胞。但是一般的光动力学疗法虽然不使用有毒药物,但其面临一些关键而棘手的问题,如ROS寿命短(200 ns),扩散距离短(20 nm),紫外/可见光几乎不能穿透皮肤和组织,以及大量消耗组织内的氧分子等,导致了该方法几乎失去实际临床价值。针对此问题,该团队一方面通过采用他们国际上最早实现的细胞核靶向药物输运策略(J. Am. Chem. Soc., 2012, 134, 5722;Adv.Mater., 2014, 26, 6742),将光敏剂直接输运至癌细胞的核内,克服了ROS寿命短、扩散距离短的问题,实现了在极低的光照条件下(0.02 W/cm2,5 min)有效抑制肿瘤生长的目的(Adv.Funct.Mater., 2014, 24, 7318–7327);此外,设计制备出纳米尺寸的闪烁颗粒/半导体核壳结构,在高穿透深度的X-射线照射下,利用闪烁颗粒将高能射线转化为紫外/可见光激发外层的半导体颗粒,从而使半导体颗粒上产生光生电子和空穴。其中的光生空穴可以直接氧化水分子,产生ROS如羟基自由基,这样既避免了紫外和可见光的穿透深度问题,又不需要消耗氧组分,使得肿瘤治疗可以持续产生疗效。(Angew. Chem. Int. Ed. 2015, 54: 1770–1774)
如何使用更简便的外源,来刺激实现瘤内的ROS的产生?该团队进一步利用超声作为刺激源,实现了声动力学(Sonodynamics Therapy, SDT)的肿瘤治疗的初步研究。超声在临床上普遍使用,无毒无害而且几乎没有穿透深度限制。他们将无毒的金属朴啉分子装载入同样无毒且生物相容性优异的介孔有机硅纳米颗粒的孔道内,当这些颗粒被肿瘤吞噬后,加上一个简单的外部超声作用,其中的朴啉分子就会分解释放出ROS和金属离子。ROS杀死癌细胞,而特定的金属离子如二价的锰离子可用于肿瘤部位的磁共振成像,实现治疗过程的监控和评估(J.Am.Chem.Soc., 2017,DOI: 10.1021/jacs.6b11846)。
更进一步地,能否不使用任何外源的响应刺激,而只是利用肿瘤内源性的特异微环境,实现不用有毒化疗药物的内源性响应的肿瘤治疗?我们知道大多数实体肿瘤高表达过氧化氢H2O2,而环境科学中的芬顿反应就是利用铁离子的催化作用产生ROS,实现有机污染物的降解。然而,这一概念无法直接用于肿瘤治疗,因为肿瘤内表达H2O2量还是太低,不足以有效启动芬顿反应以产生足够量的ROS,杀灭癌细胞。
为此,该团队提出了化学动力学(Chemodynamic Therapy,CDT)的肿瘤治疗概念。通过一种简便的方法,针对性地合成了一种奇特而新颖的软铁磁性非晶铁纳米颗粒。得益于非晶结构的高原子活性,这种纳米颗粒在肿瘤细胞间质的微弱酸性环境下即可迅速解离释放大量亚铁离子;而亚铁离子歧化瘤内累积的过氧化氢而产生大量羟自由基;最后,羟自由基引起肿瘤细胞的蛋白变性、DNA断裂、磷脂膜损伤和线粒体破坏等一系列氧化损伤,最终引起癌细胞的凋亡。与传统策略相比,该策略具有如下显著优势:(1)基于先酸解离再过氧化氢歧化的逻辑响应关系,显著提高了治疗的特异性,有效避免在过氧化氢过表达的炎症区产生副作用;(2)可在瘤内原位产生羟自由基,无需外界提供额外能量,有效避免能量穿透深度的限制以及外界能量输入所引起的副作用;(3)羟自由基在活性氧族中反应活性最高,相比于传统II型PDT所产生的单线态1O2,其具有更高效的癌细胞杀伤能力;(4)非晶铁纳米颗粒在瘤内的最终产物为生物安全的铁离子,不存在传统药物载体长期滞留的潜在毒性。(Angew. Chem. Int. Ed. 2016, 55, 2101–2106)
大家知道肿瘤的快速生长依赖于充分的氧组分和养分的供给,事实上是人体的血管系统养活了肿瘤。与以上利用氧组分或原位产生ROS的思路相反,设想如能利用某种可以进入肿瘤组织和细胞的纳米颗粒,这些颗粒能够响应肿瘤的特异性微环境,大量消耗肿瘤内的氧分子,同时阻塞其中的血管系统,阻止外部氧分子和养分的供给,就有可能实现肿瘤的饥饿治疗。然而一般的方法很难实现如上具有肿瘤特异性的局部饥饿治疗。最近,该团队采用改进的自蔓延燃烧方法,成功制备出单分散的、直径约一百纳米左右的硅化镁 (Mg2Si) 纳米颗粒。这种纳米颗粒的显著特点是,正常组织的中性环境下稳定,无毒无害;而在肿瘤的弱酸性环境下,可以与质子反应生成硅烷(SiH4)。这种硅烷分子极易与氧分子反应,从而大量而快速消耗氧组分;在此同时,产生的SiO2中间产物,原位堵塞血管,防止外部的氧分子和养分通过肿瘤血管系统的供给,从而抑制肿瘤生长,达到肿瘤治疗效果。这种策略具有如下显著的优势,1)Mg2Si纳米颗粒无毒无害,而且容易大规模制备,成本很低;2)颗粒即使大量进入正常组织也能在其中性环境下稳定存在,无副作用;而在肿瘤弱酸性下很快大量消耗氧组分,因而具有明显的肿瘤特异性;3)原位产生的副产物氧化硅同样无毒无害,却可以堵塞肿瘤血管系统,阻止外界养分和氧的供应;4)而最后,这些氧化硅颗粒还可以在一定时间后彻底降解,从而从根本上不存在毒副作用。(Nature Nanotechnology, 2017,DOI: 10.1038/NNANO.2016.280)

相关研究成果发表在《Nature Nanotechnology》上
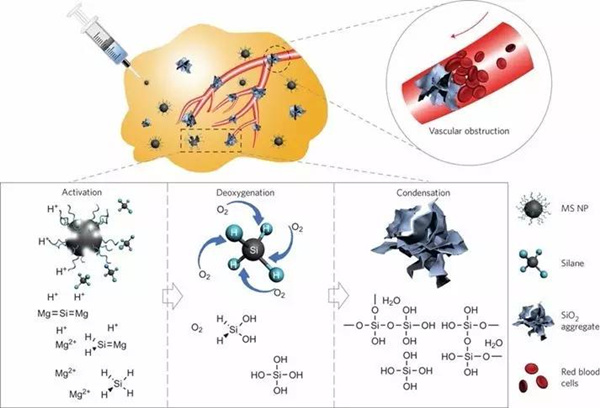
硅化镁纳米颗粒诱导肿瘤饥饿治疗原理图


 沪公网安备 31010502006565号
沪公网安备 31010502006565号