
酸中和协同免疫微环境调控新策略高效治疗骨质疏松症

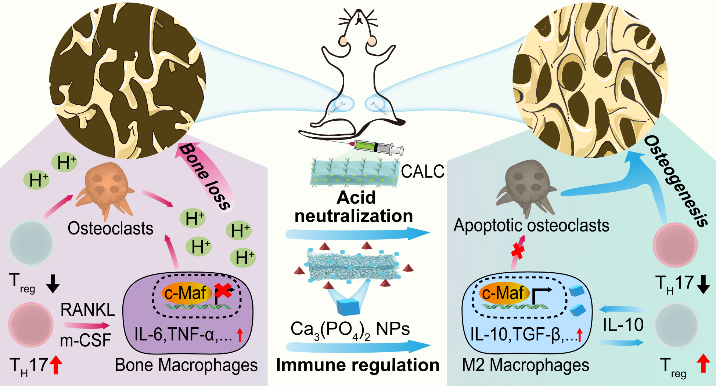
骨质疏松症是一种全球性的慢性骨病,其特征是骨量的逐渐减少和骨质量的降低,导致骨折与相关死亡的风险大大增加。在临床上,目前骨质疏松症的治疗依赖于抑制破骨细胞的骨吸收作用,但忽视了免疫细胞在骨质疏松症演化中扮演的重要角色,导致治疗效果大打折扣。
本研究设计了新型纳米催化药物——钙黄绿素(CN)修饰的钙铝层状双氢氧化物纳米片CaAl-LDH-CN(CALC)。碱性的CALC纳米片可中和骨质疏松症的酸性微环境发生降解,释放出Ca2+与内源性磷酸根离子反应生成磷酸钙纳米颗粒(CAPs),CAPs可激活c-Maf转录因子,诱导骨巨噬细胞向M2抗炎表型极化,增强调节性T细胞(Treg)的活性,并致使辅助性T细胞17(TH17)失活。体外实验和活体实验结果均显示该疗法对骨质疏松症具有良好的治疗效果,为骨质疏松症的治疗提供了一种基于免疫微环境调控的新型治疗模式。
如图1所示,通过均匀碱化法进行制备CaAl-LDH纳米片。为提高纳米片的骨靶向性能, 在CaAl-LDH纳米片表面修饰骨靶向官能团—钙黄绿素(CN)制备了骨靶向的纳米片CALC。由于CALC具有弱碱性,中和骨质疏松症病灶微环境并降解释放钙离子。释放的钙离子可与生理微环境中的磷酸根离子反应,原位生成磷酸钙纳米颗粒CAPs。CAPs通过激活c-Maf转录因子诱导骨巨噬细胞向M2型极化并分泌抗炎性细胞因子IL-10和TGF-β等,促进骨形成。
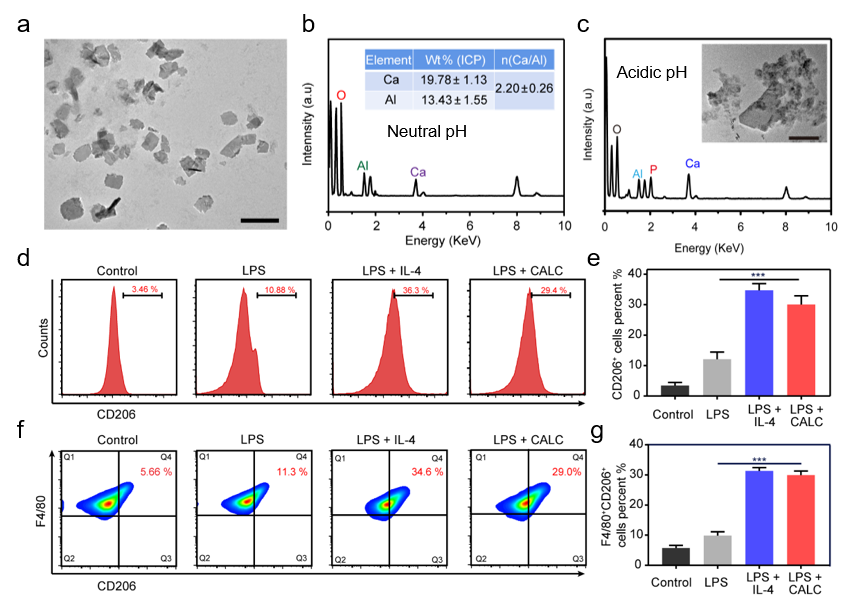
图1 CALC材料的表征与巨噬细胞调控
体内实验结果(图2)表明,经过CALC治疗的老龄鼠股骨的骨体积分数BV/TV(%)可从6.2显著增加到10.7。此外,由于抗炎性细胞因子高表达,大量招募Treg细胞,抑制TH17细胞的活性,重塑骨松免疫微环境,降低破骨细胞活性,抑制其增殖,同时增强成骨细胞活性。以上结果表明酸中和协同免疫调控的新策略有望实现骨质疏松症的高效治疗。
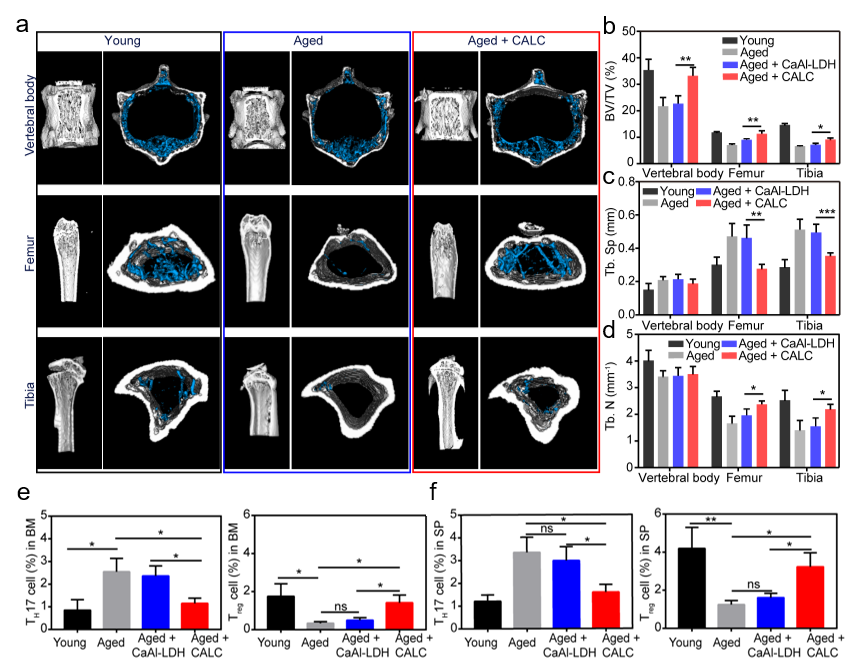
图2 CALC对老龄鼠的治疗结果及免疫细胞调控效果
该研究工作以“Acid Neutralization and Immune Regulation by Calcium?Aluminum-Layered Double Hydroxide for Osteoporosis Reversion”为题发表在Journal of the American Chemical Society期刊上(JACS,2022, https://doi.org/10.1021/jacs.2c00749)。第一作者为博士后付豪,导师为胡萍、施剑林。研究工作得到了国家自然科学基金与中国博士后科学基金的资助和支持。
(论文链接:https://pubs.acs.org/doi/10.1021/jacs.2c00749)

