
肿瘤内纳米螯合物的原位合成和肿瘤高效催化治疗
从中世纪到近现代,铁胆墨水(Iron Gall ink)一直在欧洲被广泛用作文件和音乐手稿的书写,承载着整个西方文化和艺术的发展。铁离子和没食子酸(GA)的反应是制备铁胆墨水的关键反应,生成六配位的GA-Fe纳米络合物。由于没食子酸盐的酚羟基和羧基均为给电子基团,因此在这种GA-Fe络合物中形成独特的还原性的配位场,使Fe中心具有部分二价铁的性质,可以诱发促氧化反应将氧气(O2)一步步还原为过氧化氢(H2O2),最终在酸性环境中可以通过类Fenton反应产生具有强氧化性的羟基自由基(·OH),氧化纸张中的纤维素。因此,使用铁胆墨水书写的文物在保护的过程中很容易沿着墨水的痕迹发生腐蚀作用,这是文物保护中的一个大问题。雨果的全部作品和达芬奇的大部分作品的腐蚀和铁胆墨水独特的促氧化作用有很重要的联系。
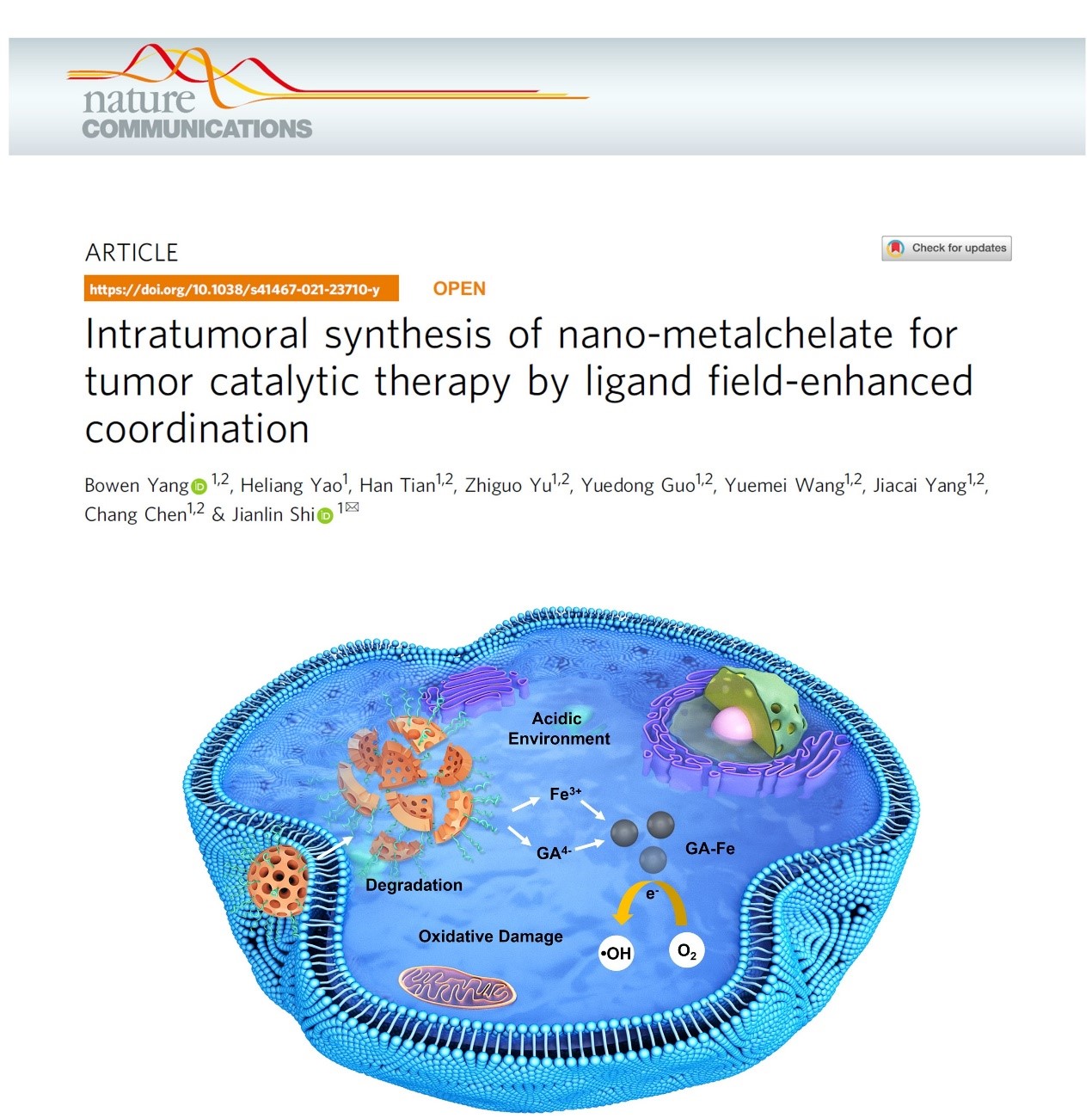
受此化学现象的启发,我们构建了铁掺杂的空心介孔氧化硅纳米颗粒(Fe-HMSNs),并将没食子酸盐负载在空腔中,来实现对肿瘤的催化治疗(图1)。这种复合纳米体系在肿瘤酸性环境中降解释放出Fe3+和没食子酸盐,原位合成GA-Fe纳米颗粒。在这种纳米络合物中,由于金属-配体之间的协同作用所形成的独特的配位场,电子在整个体系处于离域状态,可以诱发O2的两步连续的单电子还原反应产生过氧化氢,而二电子氧化后的GA-Fe纳米颗粒可以进一步把过氧化氢转变成羟基自由基,从而杀死癌细胞。
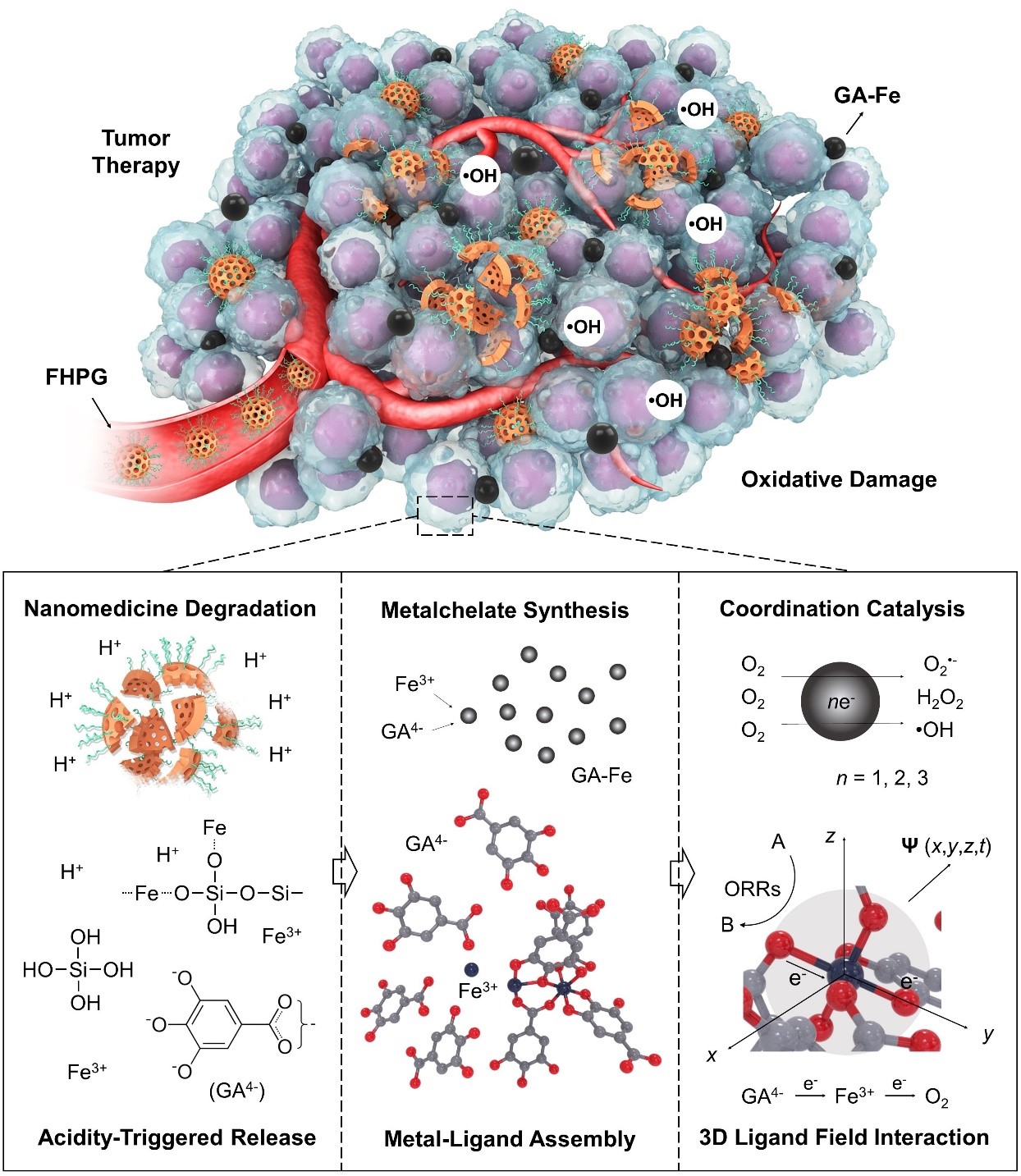
图1. 负载没食子酸盐的铁掺杂的介孔氧化硅纳米颗粒用于肿瘤催化治疗的原理示意图
我们首先合成了掺Fe的空心介孔氧化硅纳米颗粒。这种纳米载体大小约为140nm,具有粗糙的表面,明显的介孔孔道,不定型结构和-Si-O-Fe-杂化框架。这种空心纳米载体被用来高效负载没食子酸盐。在酸性模拟体液环境中,这种纳米复合药物的稳定性被进一步研究。透射电镜图像显示随着纳米颗粒的降解,周围生成很多非常小的纳米颗粒,大小约为5-20 nm。这是由于掺Fe的介孔氧化硅纳米颗粒在酸性环境中可以快速降解释放出Fe3+和在空腔中负载的没食子酸盐,引发两者之间的配位反应,最终生成GA-Fe纳米螯合物。在中性模拟体液环境中,这种纳米复合药物较为稳定,很少降解。因此,从肿瘤治疗的角度而言,这种纳米药物具有较好的特异性。
细胞实验进一步证实这种负载了没食子酸盐的掺铁的空心介孔氧化硅纳米颗粒可以在细胞内原位合成纳米螯合物,产生具有强氧化性的·OH并对癌细胞造成氧化损伤。经过这种复合纳米药物处理的HeLa癌细胞细胞活性得到明显的降低,而单一的纳米载体或者没食子酸盐处理却只能表现出轻微的抗癌效果,这证实了只有在含Fe载体和没食子酸盐都存在的情况下才能引发协同作用,促进促氧化反应的发生杀死癌细胞。最后,动物实验也进一步说明了这种复合纳米药物具有优良的抗肿瘤性能,可以显著抑制HeLa肿瘤的生长并显示出较小的副作用,对血液和正常器官没有造成明显的损伤。
该研究工作以“Intratumoral Synthesis of Nano-Metalchelate for Tumor Catalytic Therapy by Ligand Field-Enhanced Coordination”为题发表在自然·通讯Nature Communications上(Nat. Commun. 2021, 12, 3393. DOI: 10.1038/s41467-021-23710-y)(图2)。第一作者为2017级直博生杨博文,导师为施剑林院士。研究工作得到了国家自然科学基金、中国科学院前沿科学重点研究计划、上海市政府科技项目的资助和支持。

